Herzenswünsche
29.11.2023
Schweine dienen als Modellorganismen – und als potenzielle Organspender für Menschen. Ein Besuch auf dem Moorversuchsgut der LMU, wo man an den Tieren forscht.
29.11.2023
Schweine dienen als Modellorganismen – und als potenzielle Organspender für Menschen. Ein Besuch auf dem Moorversuchsgut der LMU, wo man an den Tieren forscht.
Die Hoffnung der Transplantationsmedizin ist struppig – und ziemlich neugierig: Die kleinen schwarzen Augen mustern jeden Ankömmling aufmerksam, die Schnauze hebt sich grunzend in seine Richtung. Mit seinem borstigen Fell und der etwas gedrungenen Statur erinnert das Auckland Island Pig ein bisschen an ein Wildschwein. Doch handelt es sich um eine Rasse mit einer besonderen Eigenschaft: „Das Herz eines ausgewachsenen Tieres ist ungefähr so groß wie das eines erwachsenen Menschen“, erklärt der Tiermediziner und Genforscher Eckhard Wolf, während er durch die Stallungen des Moorversuchsguts der LMU bei Oberschleißheim führt. Daher ist die Rasse womöglich ein Glücksfall für die Biomedizin. In Zukunft könnte das Auckland Island Pig als Organspender für Menschen dienen. Der Bedarf ist riesig: Rund 8.500 Menschen warten allein in Deutschland derzeit auf ein Organ; im vergangenen Jahr gab es nur etwa 850 Spenden von menschlichen Organen.
Im rustikalen Ambiente der Stallungen herrscht penible Hygiene. Die Versuchsschweine sollen sich mit keinerlei Erregern anstecken. Jeder, der zu den Schweinen will, ob Forscher, Pfleger oder Besucher, muss darum durch eine Schleuse: Vorher Schuhe und Socken ausziehen, Hände und Füße desinfizieren, dann rein und unter die Dusche, „Haarewaschen nicht vergessen“, gibt Wolf seinem Besucher noch mit. Anschließend Einmalunterhose und frisch gewaschene Kleidung anziehen. Erst von Kopf bis Fuß gesäubert darf man zu den Tieren.
Im nächsten Gehege fläzen sieben rosige Ferkel einer Hausschweinrasse regungslos unter einer Wärmelampe neben der Muttersau. „Die haben sich gerade den Bauch vollgeschlagen“, sagt Wolf, ebenfalls frisch geduscht, während er mit seinem Handy Fotos von den Tieren für seine private Sammlung schießt. „In etwa einer Stunde geht das Spiel von vorne los, dann wird wieder gesäugt“, sagt er.

Eckhard Wolf, Tiermediziner und Genforscher, leitet das Moorversuchsgut bei Oberschleißheim. | © Christoph Olesinski / LMU
Insgesamt sind in dem rund 80 Meter langen und 40 Meter breiten Hightech-Stallgebäude in der Nähe von München etwa 500 Schweine untergebracht. Etwa ein Drittel dient der Transplantationsforschung, der Rest als Modellorganismus für Erbkrankheiten oder die chronische Stoffwechselerkrankung Diabetes. „Um Krankheitsmechanismen zu untersuchen und neue Diagnoseverfahren und Therapien zu erproben, sind Tiermodelle zwingend notwendig“, erklärt Wolf. Schweine sind hierfür aktuell die besten Kandidaten, da sie dem Menschen in Anatomie und Stoffwechsel ähneln.
Um Krankheitsmechanismen zu untersuchen und neue Diagnoseverfahren und Therapien zu erproben, sind Tiermodelle zwingend notwendig.Eckhard Wolf

Lesen Sie die neuesten Erkenntnisse zum Thema Zusammenhalten in der aktuellen Ausgabe unseres Forschungsmagazins EINSICHTEN unter www.lmu.de/einsichten. | © LMU
Die Schweine, ob sie nun für die Organspende oder als Tiermodell dienen sollen, sind genetisch modifiziert. So weisen manche beispielsweise eine Mutation in einem bestimmten Gen auf, die zur Erbkrankheit Duchenne-Muskeldystrophie führt. Die Krankheit lässt Muskeln degenerieren, was am Ende zum Tode führt. Oder das Erbgut ist so verändert, dass die Tiere weniger insulinproduzierende Zellen in der Bauchspeicheldrüse entwickeln als üblicherweise. Sie können somit Glukose schlechter verwerten – so wie Menschen, die an Diabetes leiden. Bei anderen Schweinen wiederum wurden bestimmte Strukturen der insulinproduzierenden Zellen gentechnisch mit einem fluoreszierenden Farbmolekül markiert. „Auf diese Weise lässt sich der Insulinumsatz in einem lebenden Organismus verfolgen“, sagt Wolf und zeigt auf die betreffenden Tiere, die äußerlich wie ganz normale Hausschweine daherkommen: Sie grunzen, schnüffeln, quieken – und riechen, wie Schweine eben riechen.
Zurück zu den Auckland Island Pigs, deren Geschichte Anfang des 19. Jahrhunderts begann. Damals strandeten Schiffe auf den Auckland Islands 320 Kilometer südlich von Neuseeland. Mit ihnen gelangten europäische Schweine auf die Inseln. Sie paarten sich mit einheimischen Artgenossen, über die Zeit entstand so eine neue Rasse. Doch weshalb muss man ihr Erbgut für die potenzielle Organspende verändern? Für die Antwort holt Wolf aus: „Auf der Oberfläche von Schweinezellen befinden sich bestimmte Zuckermoleküle, gegen die wir Menschen Antikörper haben“, erklärt er. „Setzt man nun Schweinezellen oder komplette Schweineorgane in den Menschen ein, würden diese Antikörper an die Zuckerstrukturen binden und so körpereigene Abwehrmechanismen aktivieren.“ Diese würden in kürzester Zeit die Schweinezellen und damit das gesamte Organ zerstören.
Die Organabstoßung ist eine der größten Herausforderungen der Transplantationsmedizin – und besonders der Xenotransplantation, so nennen Fachleute die Verpflanzung von Organen zwischen verschiedenen Arten. Der Körper duldet keine Eindringlinge und bekämpft sie vehement – auch transplantierte Organe. Gleichwohl gilt: Die Reaktion fällt umso schwächer aus, je ähnlicher sich Spender und Empfänger sind. Folgerichtig sind menschliche Organe am besten für eine Transplantation geeignet, doch ist die Nachfrage viel höher als das Angebot.
Viel Hoffnung liegt daher auf den Schweinen – und der Gentechnik: „Wir schalten diejenigen Gene aus, die für die Synthese der Zuckerreste verantwortlich sind“, erklärt Wolf. Darüber hinaus wird das tierische Erbgut derart verändert, dass es die menschliche Abstoßungsreaktion hemmt. „Ein weiteres Problem ist, dass es zu Blutgerinnseln kommen kann, wenn menschliches Blut durch Schweinegefäße fließt“, sagt Wolf. Daher werden die Schweinezellen gentechnisch mit menschlichen Eiweißen ausgestattet, die die Blutgerinnung regulieren.
Gesunden Menschen erscheint die Vorstellung, mit einem Schweineherz zu leben, womöglich absurd. Für manche könnte es aber die einzige Chance sein zu überleben.Eckhard Wolf
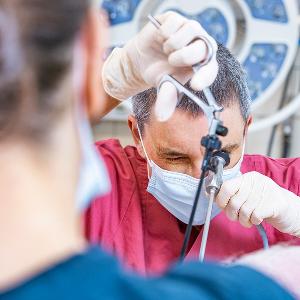
Tierärztin Barbara Kessler implantiert einen gentechnisch veränderten Embryo in den Eileiter eines Schweines. | © Christoph Olesinski / LMU
Neben den Stallungen steht ein altes Bauernhaus – die gesamte Kulisse gleicht eher der eines idealtypischen Landwirtschaftsbetriebs als der einer Forschungseinrichtung. In den einstigen Ställen sind aber hochmoderne Biotechnologie-Labore untergebracht; unzählige Gewebe- und Blutproben lagern hier in großen Tiefkühlschränken. Seit knapp 30 Jahren gibt es das Moorversuchsgut; Eckhard Wolf ist seit Anfang an mit dabei und leitet die LMU-Einrichtung seit nunmehr 27 Jahren.
In den Laboren im Erdgeschoss des Bauernhauses verändern Wolfs Mitarbeiterinnen und Mitarbeiter zunächst in einer einzelnen Schweinezelle das Erbgut. Dazu nutzen sie unter anderem die Genschere CRISPR/Cas9, ein molekulares Skalpell, mit dem sie die DNA präzise durchtrennen und Abschnitte daraus entfernen oder neue einfügen können. Den gentechnisch veränderten Zellkern pflanzen die Forschenden dann in eine entkernte Eizelle ein, eine Technik, die erstmals im Jahr 1997 beim Klonen des Schafs Dolly angewandt wurde.
„Wir haben den Versuch damals kurz darauf erfolgreich reproduziert“, erzählt Wolf und zeigt stolz den Arbeitsplatz, an dem das bahnbrechende Experiment stattfand. Aber zurück zur Methode: „Aus den präparierten Eizellen wachsen Embryonen heran, die dann in die Eileiter einer Sau eingesetzt werden“, fährt der Klon-Experte fort. Klappt alles, kommen einige Monate später Ferkel zur Welt, die eine gezielte genetische Veränderung aufweisen. Diese Tiere lassen sich dann ganz normal über Zucht weitervermehren.
Wie weit ist Wolf mit seinen Arbeiten? Wann können die Schweineherzen in Menschen verpflanzt werden? „Ich denke, dass wir in zwei Jahren die richtigen Spendertiere haben“, sagt Wolf – also solche, die alle geplanten genetischen Modifikationen aufweisen. Die Herzen dieser Schweine müssen anschließend auf Pavianen getestet werden. „Ist diese Transplantation erfolgreich, können wir dann eine erste klinische Pilotstudie mit vier bis sechs Patienten beantragen“, so skizziert Wolf die Planungen.
In bisherigen Versuchen mit Herzen „normal“-wüchsiger Schweine an Pavianen überlebten die Affen rund sechs Monate. Die Experimente, die im Rahmen eines von der Deutschen Forschungsgemeinschaft (DFG) geförderten Sonderforschungsbereichs gemacht wurden, haben allerdings auch gezeigt, dass die jungen Schweineherzen nach der Transplantation so weiterwachsen, als würden sie sich weiterhin im Schwein befinden. Aus diesem Grund sind die Herzen irgendwann zu groß für den Brustkorb der rund 20 Kilogramm schweren Tiere. Zwar lässt sich das Wachsen gentechnisch begrenzen – aber: Je mehr genetische Modifikationen man auf unterschiedlichen Chromosomen hat, desto schwieriger wird es, durch Zucht am Ende die richtige Kombination zu erzeugen. „Aus diesem Grund haben wir uns für die kleineren Auckland Island Pigs entschieden, die ein kleineres Herz haben“, sagt Wolf.
Ich denke, dass wir in zwei Jahren die richtigen Spendertiere haben.Eckhard Wolf
Größe und Abstoßungsreaktionen könnte man also in den Griff bekommen, glaubt Wolf. Außerdem muss vor der Transplantation noch sichergestellt werden, dass das tierische Spenderherz nicht mit Viren infiziert ist. Dem ersten Xenotransplantations-Patienten David Bennett ist vermutlich genau das zum Verhängnis geworden. Am 10. Januar 2022 bekam der US-Amerikaner als erster Mensch überhaupt ein genetisch modifiziertes Schweineherz eingepflanzt.
Bennett litt an einer fortgeschrittenen Herzinsuffizienz, begleitet von Herzrhythmusstörungen. Aufgrund seiner fortgeschrittenen Erkrankung und weil er sich nur unzureichend an die therapeutischen Maßnahmen hielt, galt er als ungeeigneter Empfänger eines menschlichen Spenderherzens. Das Schweineorgan war daher seine einzige Chance. Zwei Monate nach dem Eingriff verstarb Bennett – wahrscheinlich wegen Schweineviren. „Durch einen einfachen Antikörpertest am Spendertier hätte man eine solche Infektion im Vorfeld entdecken können“, sagt Wolf. „Bennetts Gesundheitszustand war aber vorher schon außerordentlich schlecht. Vermutlich hätte ihn eine Xenotransplantation ohnehin nicht langfristig retten können.“
War die Transplantation aus seiner Sicht dennoch ein Erfolg? „Es war“, so räumt Wolf ein, „ein gewagtes Experiment“, was die Überlebenschance des Patienten anbelangt, selbst wenn man von vermeidbaren Komplikationen absieht. Auch war das Risiko eines Rückschlags für die gesamte Forschung rund um die Xenotransplantation sicherlich groß. Das Experiment habe aber gezeigt, so LMU-Forscher Wolf, dass der Ansatz funktionieren kann – sogar bei einem Patienten, der alles andere als ideale Voraussetzungen mitbrachte.
Für welche Patientengruppe aber wäre ein solcher Eingriff eine vertretbare Option? Wolf definiert einen „idealen“ Patienten so: „Es ist einer, bei dem man mit einem positiven Effekt für seine Gesundheit rechnen kann. Und für den gleichzeitig kein menschliches Herz oder mechanisches Unterstützungssystem infrage kommt.“ Als Beispiel nennt er etwa Krebspatienten, die aufgrund ihres hohen Sterberisikos kein menschliches Organ bekommen. Oder Kleinkinder mit schweren Herzmissbildungen, hebt Wolf hervor. Für diesen Altersbereich gibt es nur sehr wenige menschliche Spenderherzen.
„Gesunden Menschen erscheint die Vorstellung, mit einem Schweineherz zu leben, womöglich absurd“, sagt Wolf. „Für manche könnte es aber die einzige Chance sein zu überleben.“ Entsprechend könnte aus den Schweineherzen, wie auch bei anderen medizinischen Entwicklungen, ein Geschäft werden, weil Spenderorgane ein sehr knappes Gut sind. Die Züchtung der Tiere läge dann nicht mehr in den Händen der Forschungseinrichtungen, sondern von Unternehmen. „Die Kosten für eine Schweineherztransplantation werden sich an mechanischen Herzunterstützungssystemen orientieren, also voraussichtlich im Bereich zwischen 80.000 und 150.000 Euro“, schätzt Wolf.
Dabei wird es nicht nur um Herzen gehen. „Theoretisch sind unsere Herzspenderschweine auch als Nierenspender geeignet“, sagt Wolf. Außerdem arbeiten die Forschenden des Moorversuchsguts schon jetzt an Schweinen, die als Spender von Pankreasinseln zur Behandlung von Typ-1-Diabetes infrage kommen. Pankreasinseln sind Zellansammlungen in der Bauchspeicheldrüse, dem Pankreas, die die Höhe des Blutzuckers registrieren und Insulin herstellen. Bei Patienten mit Typ-1-Diabetes arbeiten diese Pankreasinseln nicht richtig.
Es gibt de facto kein Medikament, das ohne Tierversuche in die Klinik gekommen ist.Eckhard Wolf
All das sind denkbare Xenotransplantationen. „Weit mehr Patienten“, so betont Wolf, „profitieren aber am Ende von der Modellorganismus-Forschung.“ Nur mithilfe solcher Experimente ließen sich neue Therapie- oder Diagnoseansätze in die Klinik bringen. Wolf nennt als Beispiel Experimente an den Tieren mit Duchenne-Muskeldystrophie, an denen die Forschenden ein neues bildgebendes Diagnoseverfahren testeten. Der nicht-invasive Ansatz könnte den sechsminütigen Gehtest ersetzen, mit dem Ärzte standardmäßig das Fortschreiten von DMD und die Auswirkungen einer Behandlung überwachen. Bei der neuen Methode ist das Ergebnis nicht abhängig von der Motivation der Betroffenen und ihrer verbleibenden Gehfähigkeit.
Eine Frage der Verhältnismäßigkeit
Bei allen Erfolgen: Was ist mit der Kritik von Tierschützern? Die erreiche ihn selten, sagt der Tiermediziner. Man habe ja nichts zu verbergen und sei sehr transparent. „Es darf natürlich kein einziger unnötiger Tierversuch stattfinden – und die Experimente dürfen nur von Experten gemacht werden, die dafür ausgebildet sind“, mahnt er. Nur so sei sichergestellt, dass unnötiges Leiden wirklich vermieden werde. Auch der Deutsche Ethikrat forderte schon 2011 – wie bei allen Tierversuchen – „eine artgerechte Haltung der Versuchstiere und die Vermeidung von Schmerzen infolge des Einbringens eines menschlichen Gens“. Gegen eine Genmanipulation an Tieren zu Versuchszwecken hat das in dieser Frage maßgebliche Gremium nichts Prinzipielles einzuwenden.
Wolf präzisiert hier seinen Ansatz: „Wenn ein Schwein einem Menschen das Leben rettet, dann ist das Schweineleben gut investiert.“ Nicht jeder sieht das so. Der Verein „Ärzte gegen Tierversuche“ etwa spricht sich gegen jegliche tierischen Experimente aus. „Es gibt de facto kein Medikament, das ohne Tierversuche in die Klinik gekommen ist“, widerspricht Wolf. Und schließlich wäre da noch die Frage der Verhältnismäßigkeit: „Seit Jahrzehnten werden in Deutschland rund fünfzig Millionen Schweine pro Jahr für die Fleischproduktion geschlachtet. Nur wenige Tausend werden im gleichen Zeitraum zu wichtigen Versuchszwecken eingesetzt“, argumentiert Wolf.
Auf dem Moorversuchsgut haben die Schweine anders als in der Massentierhaltung vergleichsweise viel Platz und können sich in der Gruppe frei bewegen, zeigt Wolf. Ins Freie dürfen die Tiere allerdings nicht, die Stallungen sind vollständig geschlossen und zusätzlich von einem weitläufigen Zaun umgeben, damit Wildschweinen dem Gebäude nicht zu nahe kommen. An frischer Luft besteht immer das Risiko, dass sich die Schweine mit Krankheitserregern infizieren. Und das wäre verheerend, im schlimmsten Fall könnte es viel Geld und die Arbeit von Jahrzehnten zunichtemachen.
Text: Janosch Deeg
Prof. Dr. med. vet. Eckhard Wolf ist Inhaber des Lehrstuhls für Molekulare Tierzucht und Biotechnologie am Genzentrum und am Veterinärwissenschaftlichen Department der LMU. Wolf, Jahrgang 1963, studierte Tiermedizin an der LMU; Promotion ebenfalls dort. Er war Postdoktorand zunächst am Institut für Tierzucht der LMU, dann Arbeitsgruppenleiter an der Veterinärmedizinischen Universität Wien, wo er sich auch habilitierte, bevor er im Jahr 1995 als Professor an die LMU zurückkam. Wolf ist Direktor des Centers for Innovative Medical Models (CiMM) an der LMU und Sprecher des DFG-finanzierten Sonderforschungsbereichs „Biologie der xenogenen Zell- und Organtransplantation – vom Labor in die Klinik“.
Lesen Sie weitere Beiträge von „EINSICHTEN. Das Forschungsmagazin“ im Online-Bereich und verpassen Sie keine Ausgabe, indem Sie den E-Paper-Alert aktivieren.
Oder abonnieren Sie die Printversion von EINSICHTEN kostenlos.